国家纳米科学中心陈春英院士团队AHM综述:纳米材料——膝关节骨性关节炎治疗的最新进展
时间:2024-10-05 17:01:04 热度:37.1℃ 作者:网络
膝关节骨性关节炎(Osteoarthritis, OA)是最常见的关节退行性疾病,也是导致关节疼痛和残疾的主要原因之一,给社会带来了巨大的经济和医疗负担。然而,由于效率低、不良反应和作用时间短等缺点,目前用于治疗膝关节OA的传统治疗方法的临床疗效在很大程度上受到限制。因此,亟需开发疗效好、副作用低的新型药物来解决这些问题。近年来的大量研究表明,功能性纳米材料有望弥补OA传统治疗方法的不足。

基于此,中国科学院院士、国家纳米科学中心陈春英研究员团队在Advanced Healthcare Materials以“Nanomaterials: Recent Advances in Knee Osteoarthritis Treatment”为题发表综述文章。国家纳米科学中心与郑州大学联合培养硕士生彭玉丰和首都医科大学附属北京积水潭医院王莹副研究员为该论文的共同第一作者,中国科学院院士、国家纳米科学中心陈春英研究员,周会鸽副研究员以及首都医科大学宣武医院史可鉴副研究员为共同通讯作者。该工作得到国家重点研发计划项目、新基石科学基金项目、国家自然科学基金项目、中国科学院战略重点研究计划、北京市自然科学基金等的大力支持。
该综述从纳米材料的载体功能和理化性质等方面详尽阐述了纳米材料在OA治疗中的应用。在此过程中,纳米材料的设计概念、机理和应用得到了充分的阐述。具体而言,该文章首先介绍了纳米材料作为载体在OA药物递送中的应用。纳米载体的靶向特性主要通过靶向修饰和响应式设计获得,其中,靶向修饰主要通过对关节具有高亲和力的物质获得,而响应式设计则通过内外刺激确定,以准确释放OA药物。其次,根据纳米材料的光热转化、催化和力学性能,充分讨论了不同种类的纳米材料在OA的镇痛、抗炎和润滑方面的直接治疗价值。此外,该文章还介绍了细胞膜包覆纳米材料的仿生功能,从而提高纳米材料的生物相容性和同源靶向性。最后,在此基础上提出了当前纳米材料在OA临床应用中的瓶颈和可能的改进策略。
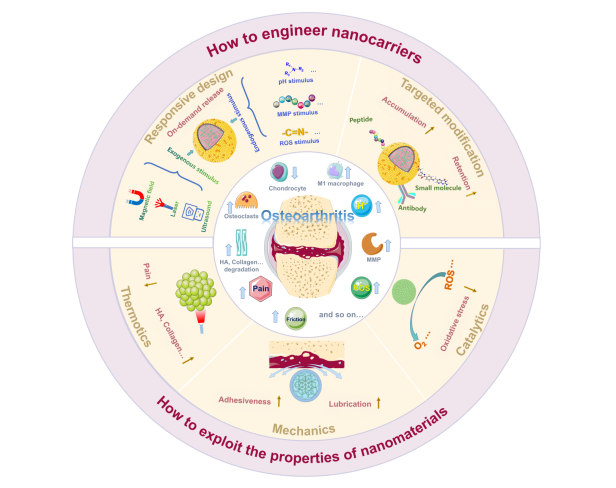
图1、 纳米材料在膝关节OA治疗中的最新进展示意图。
【文章亮点】
1.该文章从如何设计纳米载体和如何利用纳米材料自身的独特性质等方面描述了纳米材料在膝关节OA治疗中的研究进展。通过这种方式,旨在为读者提供一个关于纳米设计策略的工具箱,促进纳米技术来在制造新型OA治疗药物中的进一步应用。
2. 归纳总结了纳米材料应用于膝关节OA领域的具体研究事例,并将其从作用机制、纳米剂型、给药频率和应用动物模型等方面进行比较。此外,作者还总结了当前纳米材料在OA治疗的临床转化方面的挑战,并讨论了潜在的解决方案。
【图文导读】
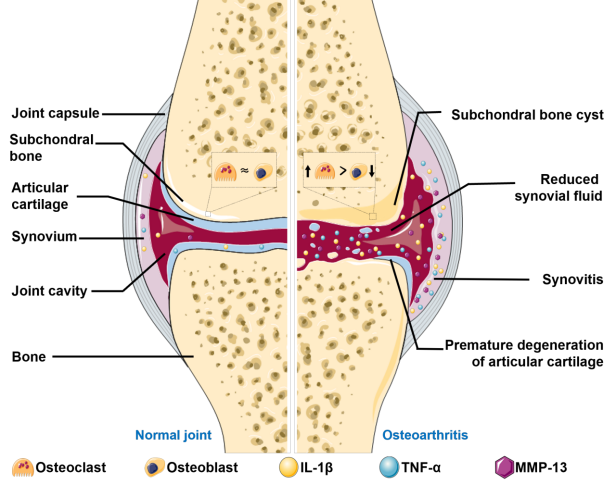
图2、膝关节OA的病理生理学特征。
膝关节OA是一种全关节疾病,不同组织协同参与OA病理。在OA的早期阶段,许多细胞外基质(ECM)碎片和蛋白质降解产物从软骨释放到关节间隙,这反过来刺激滑膜分泌促炎相关因子,如白细胞介素-1β (IL-1β)和肿瘤坏死因子-α (TNF-α),导致具有加速分解代谢特性的蛋白酶表达增加。因此,当增加的蛋白酶降解软骨基质和软骨细胞时,产生ECM碎片和蛋白质降解产物,导致滑膜维持慢性低水平炎症的恶性循环。由于软骨细胞的分裂和分化能力有限,轻度炎症环境导致软骨ECM的过度破坏,超过了ECM的修复或合成过程。随着骨性关节炎的进展,这种持续的恶性病理循环最终导致软骨退变、软骨下骨生长、滑膜炎和关节力学改变等特征。
一般来说,骨性关节炎的中心事件在于机械应力或炎症刺激导致软骨细胞失调。骨性关节炎的主要病理生理机制包括软骨细胞的合成代谢紊乱和分解代谢表型增加,滑膜细胞介导的炎症,以及软骨下骨中破骨细胞和成骨细胞之间转化的不平衡。
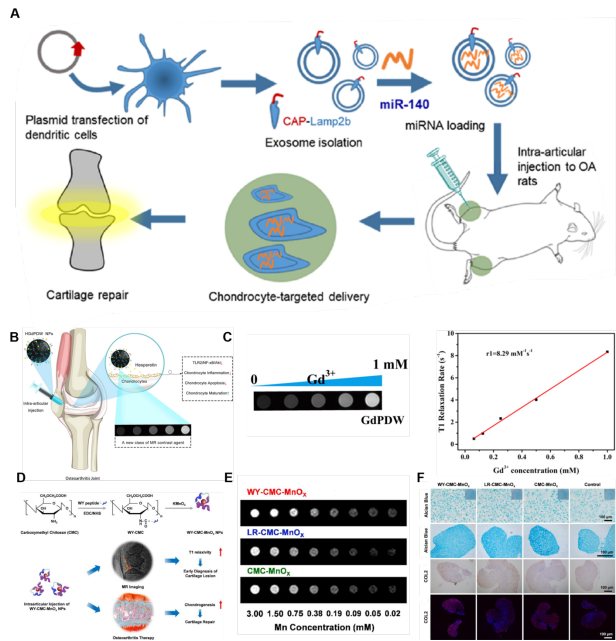
图3、软骨靶向纳米载体改善滞留。(A)用于外泌体的表面工程过程示意图,目的是促进miR-140靶向递送到软骨细胞,以达到OA治疗的目的。(B) HGdPDW NPs可能通过下调TLR2/NF-κB/Akt信号的表达来保护软骨,从而减轻软骨细胞炎症和凋亡,并可能作为OA治疗的方案示意图。(C) GdPDW NPs在3.0-T临床MR扫描仪下的体外MRI表现及GCPD-PEG-DW的T1松弛度(r1)值。(D)WY-CMC-MnOx NPs作为早期OA诊断剂的合成示意图。(E)不同Mn浓度的WY-CMC-MnOx NPs(上)、LR-CMC-MnOx NPs(中)和CMC-MnOx NPs(下)的T1加权MRI图像。(F)不同处理组的骨髓间充质干细胞微球分别经阿利新蓝染色、免疫组织化学染色和免疫荧光染色的结果图。
目前OA的给药方式主要是关节内注射,导致药物在病变处大量积聚。然而,有限的保留行为降低了药物的治疗效果,这是一个迫切需要关注的问题。幸运的是,软骨、滑膜和软骨下骨的生物学特性为纳米载体的表面设计提供了一个有希望的靶点,以实现患病关节内的长期药物滞留。这些成分也是OA治疗中调节的目标。
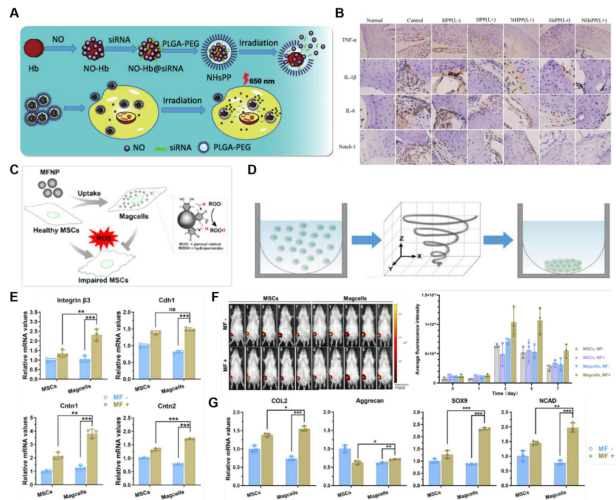
图4、外源性反应靶向纳米材料在OA治疗中的应用。(A) NHsPP纳米粒子的组装过程表现出光热响应。(B)正常小鼠和OA小鼠每次治疗后关节组织的组织学分析。(C) MSCs摄取MFNPs形成抗氧化损伤增强的Magcells的示意图。(D) TMF作用下X - Z平面Magcells的组装过程示意图。(E) Magcells细胞粘附和细胞通讯相关基因的表达。(F)有时变磁场或无时变磁场作用的SD大鼠不同天数的IVIS图像及定量分析。(G)时变磁场作用对Magcells中软骨相关基因表达的影响。
反应性靶向策略在减少药物不良反应或毒副作用方面具有优势,是病灶部位靶向策略不可或缺的重要组成部分。目前的响应性靶向可分为两大类:外源性反应和内源性反应。
在人类或动物中,皮肤、肌腱、韧带和肌肉纤维被认为是致密组织。因此,传统的外部刺激很难穿透皮肤、关节腔,甚至更深层。目前主要的外部刺激形式是近红外光(NIR)、磁场和超声波,它们不受穿透深度的限制。
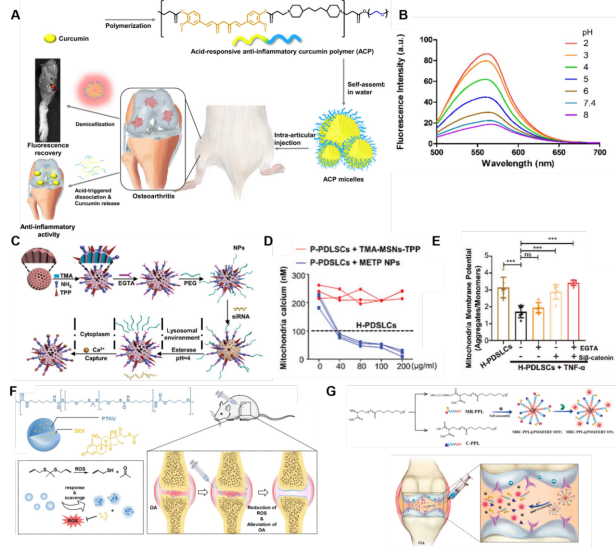
图5、内源性反应性靶向纳米材料在OA治疗中的应用。(A)METP NPs控制线粒体钙水平和调节间充质干细胞中线粒体自噬。(B)分别在2.0、3.0、4.0、5.0、6.0、7.4和8.0的pH值下测量ACP胶束的荧光光谱。(C) METP NPs的结构和功能示意图,阐述加载siβ-catenin(称为METP/siβ-catenin)的METP NPs如何促进去除受损线粒体并随后恢复线粒体和间质干细胞的功能。(D)用不同浓度的TMA-MSNs-TPP和METP NPs处理P-PDLSCs后,观察到线粒体钙的变化。(E) TNF- rp和不同NPs处理后PDLSCs线粒体膜电位的恢复程度。(F) PTKU@DEX NPs的治疗机制。(G) MMP-13和pH响应MRC-PPL@PSO OA纳米胶束的合成过程和工作机制示意图。
在OA的病理过程中,软骨细胞处于炎症环境中,导致基质金属蛋白酶家族中几种蛋白的表达增加,同时ROS的产生水平较高,导致骨性关节炎微环境呈弱酸性。刺激响应纳米材料为研究人员提供了一个工具箱,可以根据OA的特征(如独特的pH值、ROS或酶表达)来制造各种纳米药物递送系统。
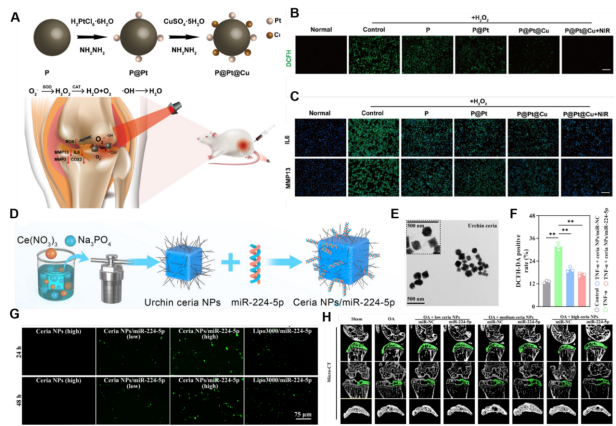
图6、基于纳米材料独特催化性能的应用。(A) P@Pt@Cu NPs的制造过程示意图,以及通过注射IA治疗OA降低ROS水平的相关假设。(B)用浓度为100 mM的H2O2处理30分钟后,将软骨细胞与浓度为100 mg/mL的PDA NPs孵育24小时,评估软骨细胞内ROS水平。(C)利用荧光显微镜观察经H2O2 (100 mM, 30 min)和PDA NPs (100 mg/mL)培养24小时处理的软骨细胞中IL-6和MMP-13的表达。(D) Ce(NO3)3·6H2O、Na3PO4和去离子水水热反应合成海胆样ceria NPs,并与miR-224-5p结合。(E)球形氧化铈NPs的透射电镜图像。(F)不同处理下DCFH-DA阳性率的统计分析。(G)基因(FITC荧光,绿色)与不同浓度的ceria NPs/miR-224-5p共培养24和48小时后,软骨细胞中基因的转染情况。(H)micro-CT结果显示不同组别骨量和软骨下骨微结构的代表性图像。
纳米材料具有粒径小、比表面积大、表面原子配位不足、独特的电子运动状态、易于表面修饰和表面能高等特点。除了作为载体外,这些独特的物理化学性质使纳米材料具有强的催化性能、高的热转换效率和机械性能。
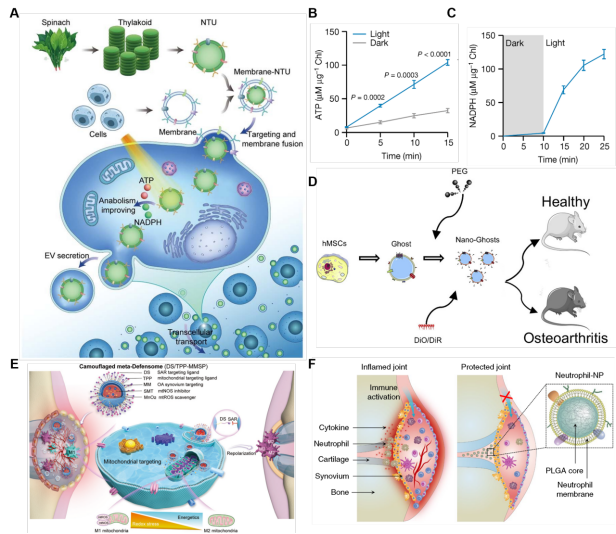
图7、用于OA治疗的细胞膜仿生纳米材料。(A) CM-NTUs NPs的OA治疗机制示意图。(B) CM-NTUs体外ATP生产能力。(C)在不同剂量的外源性铁氧还蛋白:NADP+还原酶的作用下,研究NTUs在体外产生NADPH的能力。(D) NGs的制作过程示意图。(E)巨噬细胞覆膜制备工艺ChS@GC。(F) M1滑膜巨噬细胞DS/TPP-MMSP靶向线粒体代谢重编程示意图。
纳米材料在OA的诊断和治疗方面得到了广泛的探索。除了使用载体纳米材料作为递送系统和应用纳米材料的固有特性外,还存在其他几种治疗方法。然而,纳米材料,特别是碳或无机纳米材料的生物相容性和靶向效率有限,极大地限制了它们的临床应用。纳米仿生策略应运而生,即在纳米材料表面包裹生物细胞膜,以增强纳米材料的生物相容性和同源靶向性。这一策略显著降低了纳米制剂治疗OA的潜在毒性,提高了治疗效果。
【总结展望】
总的来说,合理设计具有良好安全性能的纳米材料可以指导改善其在生物医学领域中的应用,但在应用于OA治疗的理想纳米材料的开发过程中,仍有一些问题有待解决和优化。
首先,作者认为纳米材料的毒副作用是OA治疗领域所面临的主要挑战。目前,大量的研究都集中在外源性OA治疗物质的开发上。虽然一些设计具有明显的优势,并且在动物模型中亦取得了显著的实验效果,但在临床实践中仍面临一些挑战。最根本的原因可能是人体对外源性物质的排斥反应。因此,功能性内源性物质的开发和相关纳米药物的合成在OA治疗中具有极大的潜力。
其次,病灶部位的蓄积效率以及缺乏合适的生物安全性评价方法是阻碍纳米药物临床应用的挑战。尽管在临床前研究中,通过纳米材料的设计,在改善OA组织中的药物靶向和滞留方面取得了很大进展,但由于关节的特殊结构,许多问题仍未得到解答,例如药物在靶向部位的准确积累以及相关的滞留机制。此外,受实验时间的限制,安全性评价多集中于急性毒性和短期评价;然而,为了确保纳米药物潜在的临床应用价值,还需要进行长期观察。最重要的是,安全性评价方法是确定纳米药物与生物系统之间复杂相互作用的必要条件。作者的团队已经开发了一些基于纳米冠的方法来处理这一问题,如蛋白质组学分析、原位同步辐射测量和长期健康观察,这些方法为纳米安全性提供了新的见解。考虑到许多问题仍然没有答案,纳米信息学工具包括计算机分析和分子动力学模拟可能在未来提供改进的方法。基于纳米结构和理论模型预测治疗机制,未来的工作可能有助于开发新型、安全、高效的纳米材料。
第三,从动物模型到临床试验的转化也存在挑战,患者软骨紊乱的临床特征通常比实验动物和细胞模型更为复杂。常见的实验动物,如大鼠和小鼠,软骨厚度在700微米以下,而人类的软骨厚度大于前者。因此,纳米材料的渗透和滞留行为在物种之间是不同的。基于从普通实验动物获得的数据,可能会高估了药物的传递能力。在临床进一步评估纳米材料治疗OA的疗效时,应考虑到这一重要问题。因此,应进一步开发与人类生理病理结构相似的OA实验模型,以绘制OA特征,加快纳米药物的研发进程。
第四,解决纳米药物的大规模生产问题应该被视为一个重要挑战。大多数精心设计的纳米药物具有多种成分和精细结构,以便获得独特的物理化学特性和出色的OA治疗性能。由于原料价格昂贵,制备工艺复杂,以及纯化程序过于繁琐,导致纳米药物产量低,批次间稳定性差,从而阻碍了工业化生产。因此,即便大多数纳米药物对OA治疗具有显著的治疗效果,但很少在临床应用。作者呼吁应鼓励进一步的研究,以解决纳米材料生产和从实验室到市场的转变问题。
最后,值得注意的是,在设计用于OA治疗的下一代纳米药物时,应该考虑效率和安全性之间的平衡。鉴于其独特的性质和特点,作者相信纳米材料在未来的应用中具有显著的潜力,并希望这项工作可以为未来的研究提供实用可行的设计思路。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adhm.202400615


