Small:天津大学姬晓元团队开发仿生异质结催化剂实现原位直肠癌催化和免疫协同治疗
时间:2024-07-31 18:00:25 热度:37.1℃ 作者:网络
临床应用中,催化疗法已显示出巨大的潜力。然而,传统的催化疗法依赖于活性氧(ROS)进行治疗,在有效抑制肿瘤复发和转移方面存在局限性。
2024年7月20日,天津大学/临沂大学姬晓元团队在Small 在线发表题为“Oral Heterojunction Coupling Interventional Optical Fiber Mediates Synergistic Therapy for Orthotopic Rectal Cancer”的研究论文,该研究开发了一种仿生异质结催化剂,可以在口服给药后主动靶向原位直肠癌。
异质结催化剂由四叶草星形BiVO4(BVO)和ZnIn2S4(ZIS)纳米片通过原位直接生长技术组成,随后聚去甲肾上腺素和巨噬细胞膜涂层形成仿生异质结催化剂(BVO/ZIS@M),该催化剂具有很高的直肠癌靶向和保留能力。耦合光纤干预技术激活异质结催化剂5个催化反应的多中心配位,包括2种原反应(O2→·O2−和CO2→CO)和3种氧化反应(H2O→·OH、GSH→GSSG和LA→PA)。这些催化反应不仅高效产生ROS/CO并消耗GSH,以诱导肿瘤细胞的免疫原性死亡,还特异性地使用乳酸(LA)作为电子供体来提高催化活性,破坏LA介导的免疫抑制微环境,实现原位直肠癌的协同催化和免疫治疗。因此,这种光纤干预技术将异质结催化疗法和免疫疗法结合起来,显示出优异的抗肿瘤效果。

近年来,越来越多的人认识到肿瘤微环境(TME)对癌症发展和治疗的重要影响。TME是富含乳酸(LA)的免疫抑制微环境。乳酸是糖酵解的代谢副产物,在TME内高水平积累,并增强肿瘤的免疫抑制。LA会损害免疫细胞功能并抑制抗肿瘤免疫反应,它促进免疫细胞向免疫抑制表型极化,如调节性T细胞(Tregs)和髓源性抑制细胞(MDSC),同时抑制自然杀伤(NK)细胞和效应T细胞的活化和功能。此外,LA通过抑制抗原呈递细胞(APC)的抗原呈递能力和减少促炎细胞因子的分泌来影响其功能,阻碍T细胞的活化,损害有效免疫反应的形成,最终促进肿瘤免疫逃逸。LA诱导的免疫抑制微环境也会影响TME内的其他非免疫细胞,调节血管生成、细胞外基质重塑和肿瘤细胞侵袭,从而促进肿瘤进展和转移。了解LA介导的免疫抑制机制对开发增强癌症免疫治疗效果的新策略尤为重要,相关学者正不断探索中和LA积累、靶向LA转运蛋白以及调节肿瘤细胞和免疫细胞中的LA代谢等方法来实现这一目标。
同时,LA是一种用途广泛且丰富的有机化合物,在催化化学中作为电子给体催化剂而受到广泛关注。其独特的性能适用于各种催化反应,并在不同领域得到应用,特别是在光催化领域。有学者构建了一种多孔反应器,以LA为电子供体,通过可见光驱动实现H2O到H2的长期稳定生产。LA可以作为牺牲电子供体,在光化学反应过程中补充电子,从而提高整体反应效率。研究表明,当LA用作电子供体时,催化剂的催化效率大大提高。利用LA作为电子供体催化剂在不同行业中显示出应用潜力。因此,催化化学为改善与LA相关的免疫抑制微环境提供了一条潜在路径。
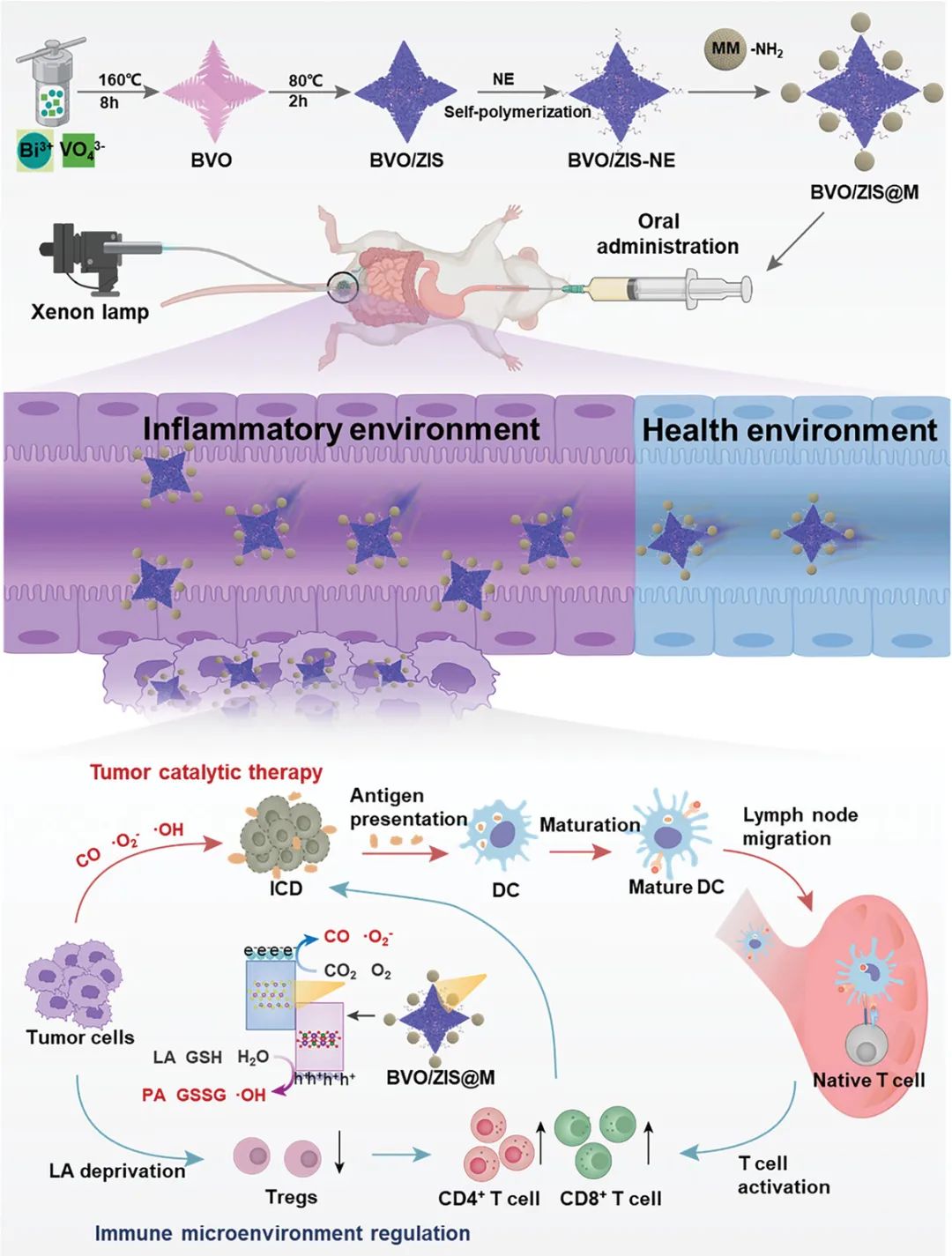
图1光纤干预介导的原位直肠癌催化和免疫协同治疗示意图(摘自Small )
基于催化化学的肿瘤疗法,称为催化疗法,已成为癌症领域的一种新型治疗方法。催化与靶向治疗的结合为癌症治疗提供了一种潜在的替代方案。该疗法中,催化剂特异性地靶向肿瘤细胞并触发特定化学反应,杀死肿瘤细胞。这些催化剂可以是纳米颗粒或其他具有独特催化性能的纳米材料,能够对肿瘤微环境中的特定信号做出反应,如pH值、活性氧(ROS)或酶活性。然而,迄今为止报道的催化治疗方法大多以单一性的ROS或其他物质为主,治疗效果单一且有限。此外,ROS的产生往往受到缺氧肿瘤微环境的限制。肿瘤异质结催化疗法是癌症治疗中的一个新兴领域,利用异质结材料的独特特性来杀死肿瘤细胞。
异质结是指两种具有不同性质的不同材料之间的界面。异质结催化剂通常由两种或多种组分组成,每种组分都有其特定的功能,不仅能有效提高催化剂的电子-空穴分离效率,还通过其多个催化活性中心介导各种催化反应,为解决传统催化剂介导的单一性肿瘤催化治疗问题提供了新思路。根据催化疗法中激发催化剂的能量来源,催化疗法可分为光催化、超声催化、压电催化、热电催化等。光催化疗法因其操作简单、光源可控性强等优点,是应用最广泛、研究最早的催化疗法之一。然而,短波长光源在人体组织中的穿透深度不足一直制约着肿瘤光催化疗法的发展。使用光纤进行肿瘤介入治疗可以有效克服穿透深度不足的问题,特别是对于结直肠癌的治疗。通过肛门,可以将光纤准确地放置在肿瘤部位,而不会造成手术创伤。
该研究制备了一种仿生异质结催化剂,该催化剂可以在口服给药后主动靶向原位直肠癌。耦合光纤介入技术激活了异质结催化剂5个催化反应的多中心配位,通过ROS/CO的高效产生和GSH的消耗诱导肿瘤细胞的免疫原性死亡,同时LA作为电子供体,提高催化活性,破坏LA介导的免疫抑制微环境,介导原位直肠癌的协同催化和免疫治疗。通过简单的水热法合成了四叶草星形BiVO4(BVO)光催化剂,可用于特异性选择LA作为电子给体。在BVO表面原位生长ZnIn2S4(ZIS)纳米片,构建BVO/ZIS异质结催化剂。
为提高口服异质结催化剂对直肠癌的靶向性和滞留能力,将自动氧化生成聚去甲肾上腺素膜的去甲肾上腺素(NE)应用于BVO/ZIS 表面,原位形成BVO/ZIS-NE。此外,将能够靶向肿瘤的巨噬细胞膜(MMs)共价交联到聚NE膜的表面,得到BVO/ZIS@M。口服一定时间后,BVO/ZIS@M主动靶向原位直肠癌部位,同时采用光纤介入激活以LA为特异性电子供体的异质结催化剂,同时催化5种不同的反应,包括(O2→·O2−和CO2→CO)和3种氧化反应(H2O→·OH、GSH→GSSG和LA→PA)。这5种催化反应可以协同诱导肿瘤细胞的免疫原性死亡,同时破坏LA介导的免疫抑制微环境。因此,这种光纤干预触发了基于BVO/ZIS@M联合催化疗法和免疫疗法的异质结,在体外和体内均表现出优异的抗肿瘤效果。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/smll.202404741


