河南大学师冰洋/港中深唐本忠院士/北理牛广乐JACS:可穿透血脑屏障的荧光抗癌药物可引发胶质母细胞瘤的类凋亡和铁死亡
时间:2024-10-14 14:01:08 热度:37.1℃ 作者:网络
目前用于胶质母细胞瘤(GBM)治疗的药物无效,主要是由于存在强大的耐药性、较差的血脑屏障(BBB)通透性和缺乏肿瘤特异性,这位药物设计带来了重大的挑战。
在此,河南大学师冰洋教授、香港中文大学(深圳)唐本忠教授和北京理工大学牛广乐教授等人报告了两种阳离子荧光抗癌剂(TriPEX-ClO4和TriPEX-PF6),它们能够通过类凋亡(Paraptosis)和铁死亡诱导BBB穿透,有效治疗GBM。这些聚集诱导发射(AIE)活性剂可特异性靶向线粒体,有效触发ATF4/JNK/Alix调节的细胞凋亡和GPX4介导的细胞凋亡。具体而言,它们迅速诱导大量线粒体衍生的空泡化,伴随着活性氧的产生、线粒体膜电位的降低和细胞内Ca2+超载,从而破坏代谢并诱导非凋亡性细胞死亡。体内成像显示,TriPEX-ClO4和TriPEX-PF6成功穿过血脑屏障靶向原位胶质瘤,并在静脉注射后启动了有效的协同治疗。该AIE药物有望成为抗耐药GBM的先锋性类凋亡诱导剂,与替莫唑胺(TMZ)(20天)相比,在耐药GBM携带小鼠中的存活期可显著延长至40天。这些引人注目的结果为荧光抗癌药物的开发和脑部疾病的创新治疗开辟了新的途径。相关工作以“Blood–Brain Barrier-Penetrative Fluorescent Anticancer Agents Triggering Paraptosis and Ferroptosis for Glioblastoma Therapy”为题发表在JACS。

【文章要点】
如图1所示,基于四苯乙烯稠合和共轭治疗性罗丹明类似物,本文开发了四种阳离子治疗性AIEgens,分别命名为TriPEX-ClO4、TriPEX-PF6、TPEX-ClO4和TPEX-PF6,用于TMZ抗性GBM治疗。作者通过荧光光谱分析、密度泛函理论(DFT)计算和晶体堆积分析研究了它们的光物理性质,以及空间位阻和反阴离子对结构-活性关系的影响。研究发现,由于其较小的空间位阻,TriPEX-ClO4和TriPEX-PF6显示出比TPEX-ClO4及TPEX-PF6更高的细胞毒性。这些带正电荷的AIEgens可以特异性靶向肿瘤细胞的线粒体,并诱导类凋亡和铁死亡。
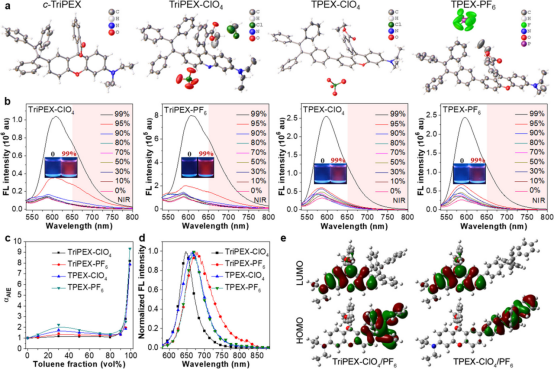
图1 AIEgens的晶体结构和光学性质
这些化合物有效地靶向11种肿瘤细胞系,比健康细胞具有更高的特异性和普遍性,特别是对TMZ抗性胶质瘤(U251-TR)细胞具有特别的疗效。实时荧光图像监测和细胞蛋白分析显示,TriPEX-ClO4和TriPEX-PF6有效地触发了ATF4/JNK/Alix调节的细胞凋亡,同时在U251-TR细胞中GPX4介导的铁死亡途径被激活。更重要的是,TriPEX-ClO4和TriPEX-PF6的平衡两亲性促进了体内血脑屏障的渗透,并可特异性靶向U251-TR细胞的线粒体,以激活静脉注射后针对原位U251-TR肿瘤的协同治疗(图2)。它使携带U251-TR肿瘤的小鼠的存活期从18天显著延长到40天,超过了TMZ治疗的对照组(20天)。此外,作者在皮下携带HeLa的小鼠中也验证了治疗效果和普遍性。
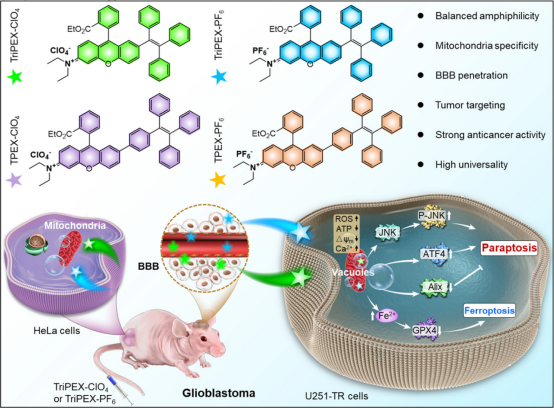
图2 AIEgens脑靶向治疗示意图
原文链接:
https://pubs.acs.org/doi/10.1021/jacs.4c07785


