好文推荐 | 93例单纯球囊扩张血管成形术与支架植入术在症状性颅内动脉粥样硬化性狭窄患者中的比较
时间:2024-10-17 18:01:09 热度:37.1℃ 作者:网络
摘要
目的 比较单纯球囊扩张血管成形术(PTA)与支架植入血管成形术(PTAS)治疗不同临床特点的症状性颅内动脉粥样硬化性狭窄(sICSA)患者的安全性及有效性。方法 回顾性分析西南医科大学附属医院2018年9月—2022年5月共计93例手术病例,根据患者的血管形态及年龄将手术方式分为PTA组(56例)及PTAS组(37例)。比较两组患者的一般资料、手术成功率、术后30 d内严重并发症发生率、术后3月MRS评分、术后6月mRS评分及术后1年责任血管再次卒中率。结果 在病变血管MORI分型C患者PTA组多于PTAS组;两组的其余基线特征无明显差异。PTA组与PTAS组的手术成功率(98.2% vs 100%),术后30 d内严重并发症发生率(3.6% vs 2.7%)以及术后3月的良好预后率(92.7% vs 94.1%)、术后6月的良好预后率(94.5% vs 94.1%)、术后1年内手术血管再次卒中率(3.6% vs 2.9%)均无明显差异。结论 在病变血管MORI分型C中,PTA安全性明显高于PTAS;其余患者两组间在手术成功率、围手术期严重并发症发生率、术后效果及术后1年症状再狭窄率均无明显差异。
脑卒中是导致全球人民死亡的第二大病因,同时也是导致中国人民死亡的第一大病因,其中缺血性脑卒中占脑卒中的绝大部分,甚至达到87%。颅内动脉粥样硬化性狭窄(intracranial atherosclerotic stenosis,ICAS)是导致全球脑梗死最常见的原因之一,ICAS导致卒中复发率很高,约4%~40%,而在亚洲人群中,症状性颅内动脉粥样硬化性狭窄(symptomatic intracranial atherosclerotic stenosis,sICAS)可能是导致脑梗死最常见原因。关于sICAS患者的治疗,目前的治疗方案有药物治疗、外科手术治疗及血管内治疗(endovaseular treatment,EVT)。EVT分为经皮球囊血管成形术(percutaneous balloon angioplasty,PTA)与支架植入血管成形术(percutaneous transluminal angioplasty and stenting,PTAS)。部分文献报道血管内治疗sICAS患者的安全性及有效性,然而对具有不同临床特点(如血管状态、年龄)的sICAS患者行EVT的安全性及有效性则缺乏报道,本研究旨在比较两种手术方式在不同临床特点sICAS患者的临床结局,以评估sICAS患者可能的最佳治疗方案。
1 资料与方法
1.1 研究对象
选择西南医科大学附属第一医院2018年9月—2022年5月行EVT的93例sICSA患者,根据病变血管MORI分类及年龄将手术方式分为PTA组(56例)与PTAS组(37例)。每位患者在术后1个月、3个月、6个月、1年经门诊或电话完成随访。纳入标准:(1)年龄≥18岁;(2)DSA证实血管狭窄率为70%~99%且狭窄远端灌注不足(DSA 示ASITN/SIR评分:0~2分、CTP提示病变血管区域CBF下降大于30%);(3)所有患者均有TIA/缺血性卒中;(4)均签署手术知情同意书。排除标准:(1)脑梗死发病7 d内的急性期患者;(2)不能耐受手术者;(3)颅内外血管串联病变严重者;(4)血管完全闭塞者。
1.2 方法
1.2.1 资料收集
收集两组患者的性别、年龄、基础疾病(高血压、糖尿病、高脂血症、房颤、冠心病)、吸烟史、饮酒史、术前NIHSS评分、发病至手术时间、手术持续时间、病变血管部位及血管MORI分类等资料。
1.2.2 手术成功标准
血管残余狭窄小于正常血管直径的50%且病变血管狭窄程度改善>20%。
1.2.3 手术简要过程
麻醉成功后经股动脉穿刺植入8F动脉鞘,经泥鳅导丝植入6F导引导管。经6F导引导管造影选择合适的工作角度并全身肝素化(66 IU/kg)。PTA组:在路图引导下将微导丝小心穿过病变处至远端,经微导丝将尺寸约等于正常血管直径70%~80% 的球囊扩张导管定位于病变部位后缓慢加压张病变血管,观察15~20 min后达到EVT成功标准结束手术。当PTA术后血管状态不能有效维持时(血管残余狭窄小于50%)和(或)明显夹层形成影响血流时改为PTAS。PTAS组:在路图引导下将微导丝小心穿过病变处至远端,经微导丝将尺寸不小于正常血管直径50%的球囊扩张导管定位于病变部位后加压扩张血管,经微导丝将直径略小于未病变血管直径的颅内球囊扩张支架或略大正常血管直径的自彭支架送至病变处,保证支架完全覆盖病变后释放支架。造影示达到EVT成功标准后结束手术。本研究选择了10例APOLLO支架,24例EZ支架,3例Wingspan支架。
1.2.4 术前及术后治疗
患者术前均完善氯吡格雷基因检测,根据是否存在氯吡格雷抵抗,术前给予阿司匹林100 mg 1次/d+氯吡格雷75 mg 1次/d(氯吡格雷慢代谢者替换为西洛他唑100 mg 2次/d)治疗5 d以上。患者术后即刻复查头部CT,排除颅内出血后同术前给予双重抗血小板治疗直到进行随访血管造影 (3~6个月)。随访期间所有患者均控制卒中危险因素并积极行康复训练,如果没有发生血管再狭窄,在随访血管造影后采用单抗血小板治疗。危险因素控制包括控制低密度脂蛋白水平(<2.58 mmol/L),控制高血压[收缩压<140 mmHg (糖尿病患者<130 mmHg)和舒张压<90 mmHg],控制血糖、戒烟、戒酒、适当运动等。
1.2.5 结局指标
(1)围手术期(术后30 d)死亡率及卒中率;(2)术后3月、6月的MRS评分(0~2分为良好,3~6分为不佳);(3)1年内病变血管再卒中率;(4)随访期间的病变血管再狭窄率及症状性血管再狭窄率。症状性颅内出血定义:任何性质的颅内出血且NIHSS评分较出血前增加≥4分。血管再狭窄定义:在治疗节段内或紧邻治疗节段(5 mm内)的血管造影证实>50%狭窄且绝对管腔丢失>20%。症状性血管再狭窄定义:既往治疗过的动脉再次狭窄并伴有缺血症状。
1.2.6 随访
患者术后1月、3月、6月、1年通过门诊咨询或电话完成临床随访和评估。收集并比较两组间的一般资料(包括性别、年龄、高血压、糖尿病、高脂血症、房颤、冠心病、吸烟、饮酒史、发病至手术时间、手术持续时间、入院NIHSS评分)、术后3月、6月mRS评分、1年后病变血管区域的再卒中率以及随访期间血管再狭窄率、症状性血管再狭窄率。
1.3 统计学处理
采用SPSS 23.0统计分析,经正态性检验,正态分布计量数据以(x±s)表示,组间比较采用独立样本t检验;非正态分布计量数据以中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验,组间等级资料采用 Mann-Whitney U检验;分类变量以频率和构成比表示并采用χ2检验或Fisher精确概率法。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者一般情况的比较
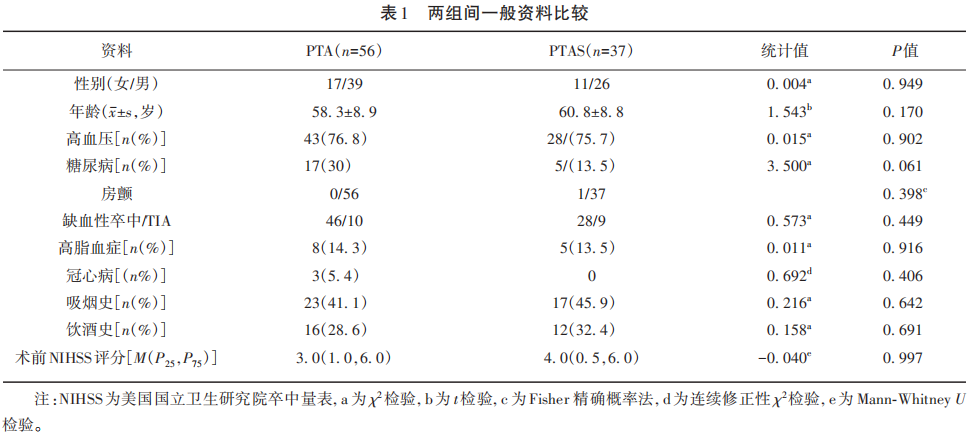
两组患者的一般情况无明显差异(P>0.05)。PTA组有1例患者有房颤,术前给予抗凝治疗,术后复查头部CT后未见出血给予抗凝治疗(见表1)。
2.2 两组间术中情况比较
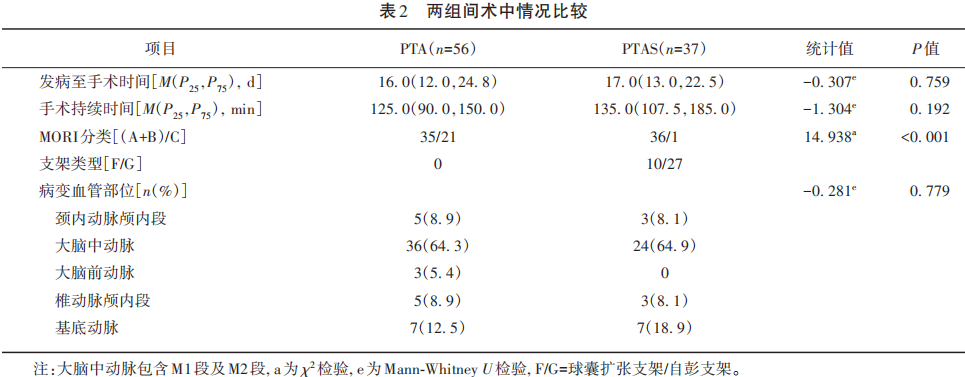
两组病例发病至手术时间、手术持续时间及手术部位等均无明显差异(P>0.05)。而病变血管MORI分类差异有统计学意义(χ2=14.938,P<0.01)。PTAS组有10例使用球囊扩张支架,27例使用自膨支架(3例Wingspan,24例EZ)。病变血管以大脑中动脉最为常见(见表2)。
2.3 两组间术后情况比较
两组病例术后30 d内死亡及卒中率无明显差异(P=1.000)。PTA组有2例脑卒中(该组21例MORI分型C),其中1例脑出血,1例脑梗死。PTAS组有1例脑出血(该组仅1例MORI分型C)。
2.4 两组间预后随访比较
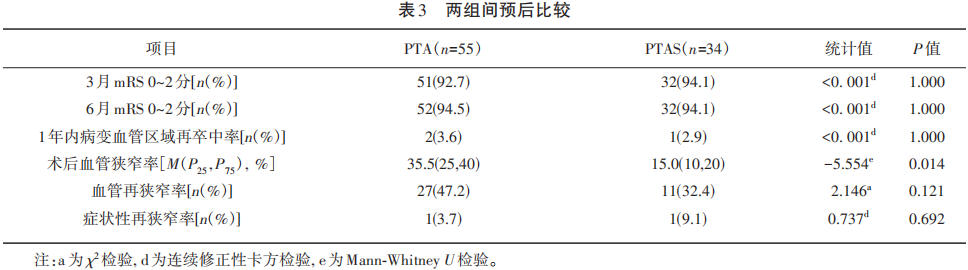
共计89例完成随访,4例随访丢失(PTA组1例,PTAS组3例)。3及6月的MRS评分、1年内病变血管区域再次卒中率均无明显差异(P=1.000)(见表3)。
所有人均完善血管检查(34例DSA、18例CTA、15例MRA、22例TCD)以评估术后血管状态,中位随访时间为8.0个月(2~24个月),其中PTA组血管内再狭窄率(47.2%)高于PTAS组(32.4%),两者之间无明显差异(P=0.121)。PTA组症状性血管再狭窄(3.7%)低于PTAS组(9.1%),两者之间无明显差异(P=0.692)。PTA组术后血管狭窄率35.5%(25%,40%)高于PTAS组15.0%(10%,20%),两者间差异明显(P=0.014)(见表3)。
3 讨 论
SAMMPRIS研究、VISSIT研究、WEAVE研究及CASSISS等研究探寻了对sICAS患者行血管内治疗的安全性及有效性,然而,sICAS患者的最佳手术方式仍未确定,故有必要比较两种手术的安全性及有效性。
由于PTA减少了在血管内的操作时间,减轻对血管壁损害的同时还可以减少再灌注损伤,针对血管迂曲、细小,支架到位困难的患者,PTA是优于PTAS的,并且可以减轻患者经济负担。
本研究中PTA组有1例因术后血管不能维持狭窄率小于50%,改为PTAS,两者在手术成功率方面无明显差异(P=1.000),EVT总的围手术期并发症为3.2%。1年内病变血管再次卒中率为3.4%,其中PTA组为3.6%(3/55),PTAS组为2.9%(1/34)。本研究中出现了1例脑梗死(在PTAS组,患者基底动脉上段穿支动脉丰富合并糖尿病);2例脑出血(其中PTA组与PTAS组各1例,患者均为MORI分型C,同时合并了高血压与糖尿病),表明对MORI分型C患者而言,PTA较PTAS更为安全。
支架植入术后血管内再狭窄率高于Wingspan研究,可能与支架选择有关。随访期间PTA组血管再狭窄率高于PTAS组,而症状性血管再狭窄率低于PTAS组,但是均未见明显差异(P>0.05),其结果可能与样本量相对较小有关。当出现血管内再狭窄时,可能因支架内完全闭塞,导致手术失败或者更多的手术并发症。
部分Meta分析显示在安全性及有效性上PTA优于PTAS,而在本研究中,两种手术方式在MORI A型及B型患者中的安全性与有效性无明显差异。
PTA相较于PTAS而言,手术持续时间应该更短,然而在本研究中两组无明显差异(P=0.192),可能与以下两个方面有关:(1)行PTA时球囊加压及泄压时更为缓慢,耗时更多;(2)球囊扩张后/支架植入后观察血管形态能否维持及远端血流情况的时间不同(PTA组观察时间比PTAS组相对更长)。
本研究存在一定的局限性:这是一项单中心的回顾性研究,相对较小的样本量可能会影响统计结果。患者选择存在偏倚。
综上,对于药物治疗无效的重度狭窄患者可以考虑行血管内治疗,对于MORI分型C及穿支动脉丰富的患者而言,PTA是优于PTAS的,而在MORI分型A及B中,两种手术在成功率、围手术期严重并发症发生率、术后效果及术后1年症状再狭窄率均无明显差异。
参考文献
[1]Wu S,Wu B,Liu M,et al. Stroke in China:advances and challenges in epidemiology,prevention,and management[J]. Lancet Neurol,2019,18(4):394-405.
[2]Saini V,Guada L,Yavagal DR. Global epidemiology of stroke and access to acute ischemic stroke interventions[J]. Neurology,2021,97(20 Suppl 2):S6-S16.
[3]Gorelick PB,Wong KS,Bae HJ,et al. Large artery intracranial occlusive disease:a large worldwide burden but a relatively neglected frontier[J]. Stroke,2008,39(8):2396-2399.
[4]Wang Y,Zhao X,Liu L,et al. Prevalence and outcomes of symptomatic intracranial large artery stenoses and occlusions in China:the Chinese Intracranial Atherosclerosis (CICAS) Study[J]. Stroke,2014,45(3):663-669.
[5]Suri MFK,Qiao Y,Ma X,et al. Prevalence of intracranial atherosclerotic Stenosis using high-resolution magnetic resonance angiography in the general population:the atherosclerosis risk in communities study[J]. Stroke,2016,47(5):1187-1193.
[6]Nordmeyer H,Chapot R,Haage P. Endovascular treatment of intracranial atherosclerotic Stenosis[J]. Rofo,2019,191(7):643-652.
[7]Luo J,Wang T,Gao P,et al. Endovascular treatment of intracranial atherosclerotic Stenosis:current debates and future prospects[J]. Front Neurol,2018,9:666.
[8]Gutierrez J,Turan TN,Hoh BL,et al. Intracranial atherosclerotic stenosis:risk factors,diagnosis,and treatment[J]. Lancet Neurol,2022,21(4):355-368.
[9]Miao Z,Jiang L,Wu H,et al. Randomized controlled trial of symptomatic middle cerebral artery stenosis:endovascular versus medical therapy in a Chinese population[J]. Stroke,2012,43(12):3284-3290.
[10]Wang Y,Ma Y,Gao P,et al. Primary angioplasty without stenting for symptomatic,high-grade intracranial Stenosis with poor circulation[J]. AJNR Am J Neuroradiol,2018,39(8):1487-1492.
[11]Dumont TM,Sonig A,Mokin M,et al. Submaximal angioplasty for symptomatic intracranial atherosclerosis:a prospective Phase I study[J]. J Neurosurg,2016,125(4):964-971.
[12]Yu SCH,Lau TWW,Wong SSM,et al. Long-term evolutionary change in the lumen of intracranial atherosclerotic Stenosis following angioplasty and stenting[J]. Oper Neurosurg,2018,14(2):128-138.
[13]Mori T,Fukuoka M,Kazita K. Follow-up study after intracranial percutaneous transluminal cerebral balloon angioplasty[J]. Interv Neuroradiol,2000,6(S1):243-249.
[14]Kernan WN,Ovbiagele B,Black HR,et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke,2014,45(7):2160-2236.
[15]Hacke W,Kaste M,Bluhmki E,et al. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke[J]. N Engl J Med,2008,359(13):1317-1329.
[16]Derdeyn CP,Chimowitz MI,Lynn MJ,et al. Aggressive medical treatment with or without stenting in high-risk patients with intracranial artery stenosis (SAMMPRIS):the final results of a randomised trial[J]. Lancet,2014,383(9914):333-341.
[17]Zaidat OO,Fitzsimmons BF,Woodward BK,et al. Effect of a balloon-expandable intracranial stent vs medical therapy on risk of stroke in patients with symptomatic intracranial stenosis:the VISSIT randomized clinical trial[J]. JAMA,2015,313(12):1240-1248.
[18]Alexander MJ,Zauner A,Chaloupka JC,et al. WEAVE trial:final results in 152 on-label patients[J]. Stroke,2019,50(4):889-894.
[19]Gao P,Wang T,Wang D,et al. Effect of stenting plus medical therapy vs medical therapy alone on risk of stroke and death in patients with symptomatic intracranial Stenosis:the CASSISS randomized clinical trial[J]. JAMA,2022,328(6):534-542.
[20]Stapleton CJ,Chen YF,Shallwani H,et al. Submaximal angioplasty for symptomatic intracranial atherosclerotic disease:a meta-analysis of peri-procedural and long-term risk[J]. Neurosurgery,2020,86(6):755-762.
[21]Nguyen TN,Zaidat OO,Gupta R,et al. Balloon angioplasty for intracranial atherosclerotic disease:periprocedural risks and short-term outcomes in a multicenter study[J]. Stroke,2011,42(1):107-111.
[22]Levy EI,Turk AS,Albuquerque FC,et al. Wingspan in-stent restenosis and thrombosis:incidence,clinical presentation,and management[J]. Neurosurgery,2007,61(3):644-650;discussion:650-651.
[23]Peng G,Li K,Wang A,et al. Medical and endovascular treatments for intracranial atherosclerotic Stenosis:a network meta-analysis[J]. Transl Stroke Res,2023,14(1):83-93.
[24]Wang T,Yang K,Zhang X,et al. Endovascular therapy for symptomatic intracranial artery Stenosis:a systematic review and network meta-analysis[J]. Transl Stroke Res,2022,13(5):676-685.


